Klorat
Bu yazımızda farklı alanlarda ilgi ve tartışma konusu olan Klorat konusuna değineceğiz. Klorat, uzmanların ve kamuoyunun dikkatini çeken, çelişkili görüşlere ve derin düşüncelere yol açan bir konudur. Tarih boyunca Klorat, toplum üzerindeki ilgisini ve etkisini gösteren çalışma, analiz ve tartışma konusu olmuştur. Bu makale aracılığıyla Klorat'e farklı bakış açılarının yanı sıra onun günlük yaşamın farklı yönleri üzerindeki etkisini keşfedeceğiz. Bu konunun öneminin ve mevcut realitemizdeki yansımalarının anlaşılması çok önemlidir, bu nedenle konuya eleştirel ve yansıtıcı bir bakış açısıyla yaklaşmak gerekmektedir.
Bu madde hiçbir kaynak içermemektedir. (Temmuz 2024) (Bu şablonun nasıl ve ne zaman kaldırılması gerektiğini öğrenin) |
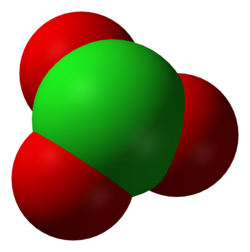
Klorat, ClO3− formülüyle gösterilen bir kimyasal kök. Bileşiklerinde daima bir adet elektron alır. Kloratlar, genel olarak klorik asitin tuzu olarak bilinirler. Klorat molekülleri organik bileşikleri kolayca oksitleyeceğinden dolayı kimyasal olarak zararlı bir maddedir. Geçmişte birçok patlayıcı ve havai fişekte kullanılan klorat, günümüzde yerini perklorata bırakmıştır.
En bilinen klorat türleri potasyum klorat (KClO3), sodyum klorat (NaClO3) ve magnezyum klorat (Mg(ClO3)2)'tır.
Üretim
Metal kloratlar, klor gazının sıcak metal hidroksitlerle karıştırılmasıyla elde edilebilir:
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Klorun iyonları
| Oksitlenme değeri | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Anyon adı | Klorür | Hipoklorit | Klorit | Klorat | Perklorat |
| Formül | Cl- | ClO− | ClO2− | ClO3− | ClO4− |
| Gösterim | 
|

|

|